九年级化学质量守恒讲解:中考化学最后一轮复习
九年级化学质量守恒讲解:中考化学最后一轮复习4、离子的定义:带电荷的原子或原子团。2)时,该元素的化学性质稳定。决定元素种类的是质子数。【小结】(1)既然核电荷数=核内质子数=核外电子数,为何不说元素是具有相同电子数的一类原子的总称呢?因为在发生化学反应时,有些原子的核外电子失去或得到(变为离子),核外电子数发生了变化。(2)区分原子种类的是质子数(即核电荷数)不同,那么区分元素的依据也是核电荷数(或核内质子数)元素的分类最外层电子数得失电子趋势化学性质举例稀有气体元素=8个(氦为 2个)相对稳定,不易得失电子稳定He、Ne、Ar 等金属元素<4个易失去最外层电子不稳定Na、K、Mg 等非金属元素≥4 个(氢为 1个)易得到电子,使最外层达不稳定N、P、S、Cl 等到 8 电子稳定结构【小结】由此可见元素的化学性质主要取决于最外层电子数。当最外层电子数达到 8(只有一个电子层时为
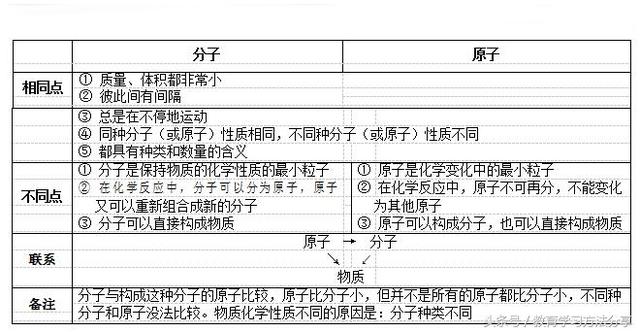
一、分子、原子的区别与

元素、离子
1. 元素的概念:具有相同核电荷数(即核内质子数)的一类原子的总称。
水是由水分子构成的,水分子是由氢原子和氧原子构成的;氧气是由氧分子构成的,氧分子又是由氧原子构成的。同种原子质子数相同,即水分子中的氧原子和氧分子中的氧原子,其质子数都是 8,化学上把质子数都是 8 的氧原子统称为氧元素。
【小结】(1)既然核电荷数=核内质子数=核外电子数,为何不说元素是具有相同电子数的一类原子的总称呢?
因为在发生化学反应时,有些原子的核外电子失去或得到(变为离子),核外电子数发生了变化。(2)区分原子种类的是质子数(即核电荷数)不同,那么区分元素的依据也是核电荷数(或核内质子数)
【小结】由此可见元素的化学性质主要取决于最外层电子数。当最外层电子数达到 8(只有一个电子层时为
2)时,该元素的化学性质稳定。决定元素种类的是质子数。
4、离子的定义:带电荷的原子或原子团。

离子的形成及分类:
(1)金属原子的最外层电子数一般少于 4 个,在化学反应中易失去电子,使得质子数大于核外电子数,所以带正电荷(核电荷数-核外电子数)为阳离子,一般电子层数减 1。
(2)非金属原子的最外层电子数一般多于 4 个,在化学反应中易得到电子,使得质子数小于核外电子数,所以带负电荷(核外电子数-核电荷数)为阴离子,电子层数不变。
5、化合价
(1)金属元素显示正价、非金属元素显示负价
(2)判断化合物中某元素化合价时利用正负化合价代数和为零的原则
(3)同种元素在不同化合物中显示不同的化合价
(4)同种元素在同一化合物中显示不同的化合价(例如:硝酸铵中 N元素化合价)
区别化合价的标示法和离子符号的标示法:
| 元素化合价的标示 | 离子符号的标示 | ||
| 区别 | (1)标在元素符号上方 | (1)标在元素符号右上角 | |
| (2)正负号在数值之前 | (2)正负号在数值后 | ||
| (3)其数值 1 要标出 | (3)电荷数值为 1 时省略 | ||
| 联系 | 符号相同,数值相同 | ||
| 1-1 | Na 、S2- | ||
| 示例 | Na 、Cl |
综上所述:元素符号、离子、化合价、化学式的意义
质量守恒定律

1、质量守恒定律概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这一规律叫做质量守恒定律。

【归纳总结】
1. 质量守恒定律的运用范围一定是化学变化,而不包括物理变化。如 1g 水加热后变成了 1g 水蒸气,这一变化前后虽然质量相等,但不能说这一变化符合质量守恒定律。
2. “参加反应的”不是各物质质量的简单相加,是指真正参与化学反应的那部分质量,没有参与反应的我们称为“剩余的”。
3. “生成的质量总和”指的是化学反应中生成的,无论是固、液、气都要加在一起。
4. “质量守恒”强调的是质量,而不包括其他方面的守恒如气体的体积等。
2、质量守恒的实质
在一切化学反应里,各反应物中的原子经过重新组合变成新的物质。在化学反应前后,原子的种类没有变化,各种原子的数目也没有增减,原子的质量也没有变化,所以化学反应前后各物质的质量总和必然相等。
【归纳总结】1、三个不变:
①反应物与生成物的总质量不变;
②反应中元素的种类不变;
③反应过程中原子的数量、种类不变;
2、两个一定改变:
①物质的种类一定改变(化学反应一定有新物质生成)
②构成物质的微粒一定改变(化学反应中,反应物变成了生成物)
3、两个可能改变:构成物质的分子的数目、元素化合价




