南京林业大学蛋白质印迹法(南京大学化学化工学院鞠熀先)
南京林业大学蛋白质印迹法(南京大学化学化工学院鞠熀先)上述相关成果已以“Activating DNA Nanomachine via Computation across Cancer Cell Membrane for Precise Therapy of Solid Tumors”为题于9月2日在Journal of the American Chemical Society(DOI: 10.1021/jacs.1c06361)在线发表。博士生张玥和陈伟伟副研究员为该工作的共同第一作者,鞠熀先教授和刘颖教授为共同通讯作者。图3. 注射LA-apt或LA'-apt、随后UCNPsCy3-DNABHQ-Cy5或UCNPsCy3-DNA'BHQ-Cy5小鼠的(a)活体荧光成像与(b)器官和肿瘤组织成像。将ROS指示剂DHR123修饰在DNA纳米机器上可验证细胞内精准光动力治疗。在细胞表面锚定LA-apt后,UCNPs-DNARB/BHQ孵育的M
DNA纳米机器是基于DNA自组装形成的纳米结构。通过嵌入多种类型的功能核酸单元,DNA纳米机器可以响应肿瘤细胞内源性刺激物(如谷胱甘肽、microRNA等)而引发结构变化,实现肿瘤细胞成像或治疗。然而,实体肿瘤的微环境复杂,肿瘤细胞周边存在大量有重要功能的健康细胞(如成纤维细胞、免疫细胞等)。传统的DNA纳米机器往往会因实体瘤微环境中内源性刺激物的影响,在其进入靶向肿瘤细胞前被误启动,对周围健康细胞造成毒副作用损伤。因此,开发一种在细胞水平上特异性激活的纳米机器,对于肿瘤的精准治疗具有重要意义。
细胞膜是隔离细胞与外部环境的天然屏障,通过核酸适配体与膜蛋白结合,可以使DNA纳米机器在细胞膜表面进行逻辑运算而产生输出信号。在前期研究中,生命分析化学国家重点实验室的鞠熀先与刘颖教授报道了基于核酸适配体和细胞膜上双受体结合的“双锁-智能钥匙”DNA逻辑门模型,并在肿瘤细胞识别与肿瘤治疗中实现了细胞亚型特异性的区分(Nat. Commun. 2016 7 13580)。然而,在细胞膜表面完成“逻辑门”运算需要依赖DNA链在细胞膜上的迁移。这一过程依靠DNA链的“脱落与再结合”,效率受限,且易产生假阳性结果。为解决这一问题,该研究组设计了一种跨细胞膜进行DNA逻辑门运算的纳米机器(图1a),其两步DNA运算分别在细胞膜上与细胞质内完成,可避免DNA纳米探针在实体瘤微环境中的非特异性激活,实现了活体内实体肿瘤的精准光动力治疗。该DNA纳米机器由上转换纳米粒子内核(UCNPs)、DNA组装体L012和H012组成(图1b)。含sgc8适配体的DNA链LA-apt与癌细胞膜上过表达的PTK-7蛋白结合,构成信号输入端1;癌细胞内高表达的miRNA-21作为信号输入端2。这两个信号输入端与DNA纳米机器上的L012部分共同形成“AND”逻辑门。

图1. (a) DNA跨膜逻辑门运算与(b) DNA纳米机器结构示意图。(c)以LA-apt与PTK-7蛋白结合构成信号输入端1、miRNA-21为信号输入端2进行跨膜运算而释放L2。(d) L2启动循环反应恢复光敏剂活性。
DNA纳米机器进行跨膜逻辑运算的过程如下:LA-apt与L012在细胞膜表面杂交,取代L1链后暴露miRNA-21的结合位点,并诱导纳米粒子进入细胞质;细胞质中的miRNA-21与纳米粒子上的L012发生链取代反应,输出信号(即释放的L2链)(图1c);释放出的L2链打开UCNPs表面修饰的H1发卡,并随后打开H2发卡重新释放L2链进行下一循环。这一过程可不断恢复光敏剂的活性,在UCNPs的绿色发射光的激发下产生活性氧,实现肿瘤细胞的光动力治疗(图1d)。
将ROS指示剂DHR123修饰在DNA纳米机器上可验证细胞内精准光动力治疗。在细胞表面锚定LA-apt后,UCNPs-DNARB/BHQ孵育的MCF-7细胞在近红外光照下有明显的ROS产生(图2a),而其对照物则不能被产生ROS(图2b)。miRNA识别位点未被封闭的对照材料UCNPs-DNA'RB/BHQ与miRNA-21孵育后,在miRNA-21阴性的MCF-7细胞中显示明显的ROS荧光;而UCNPs-DNARB/BHQ此细胞中并没有ROS产生(图2c)。因此,封闭miRNA识别位点可保证光动力治疗仅在肿瘤细胞内发生,避免对正常细胞组织的损伤,从而实现癌细胞的精准高效光动力治疗(图2e)。
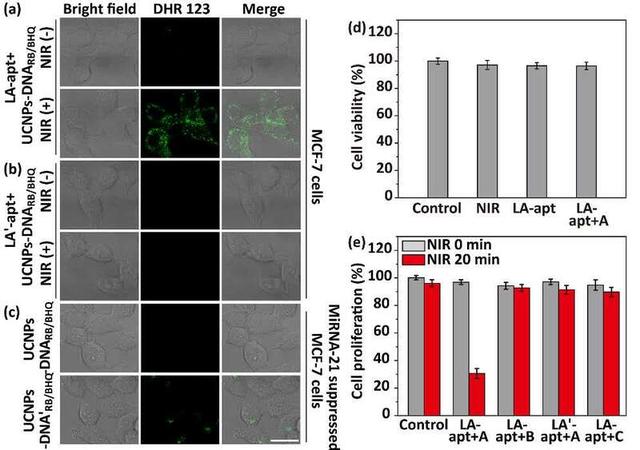
图2. (a) LA-apt和(b) LA'-apt锚定的UCNPs-DNARB/BHQ处理MCF-7细胞后的共聚焦成像。(c) LA-apt锚定miRNA-21阴性的MCF-7细胞在UCNPs-DNARB/BHQ或UCNPs-DNA'RB/BHQ处理后的共聚焦成像。(d) MCF-7对照细胞与分别不同方式处理后的MCF-7细胞的细胞存活率。(e) MCF-7对照细胞、在UCNPs-DNARB/BHQ (LA-apt A)、UCNPs-nrDNARB/BHQ (LA-apt B)或UCNPs-DNA (LA-apt C)处理后的LA-apt锚定MCF-7细胞、UCNPs-DNARB/BHQ处理后(LA'-apt A)的LA'-apt锚定细胞的细胞增殖率。
DNA纳米机器进行光动力治疗的效果在动物层面也得到验证(图3)。通过在UCNP表面与L0链末端分别标记Cy3以及Cy5,得到双色纳米机器UCNPsCy3-DNABHQ-Cy5,同时发卡H1末端修饰的BHQ使Cy3荧光的猝灭。通过Cy5对DNA纳米机器在活体内的递运示踪,通过Cy3的荧光恢复显示DNA纳米机器的激活。从小鼠荧光成像可看出,尽管纳米材料会部分进入肝脏,只有肿瘤处有明显的Cy3荧光,证明该DNA纳米机器的跨膜运算仅在肿瘤细胞中激活,而不会对正常器官组织造成损伤。

图3. 注射LA-apt或LA'-apt、随后UCNPsCy3-DNABHQ-Cy5或UCNPsCy3-DNA'BHQ-Cy5小鼠的(a)活体荧光成像与(b)器官和肿瘤组织成像。
上述相关成果已以“Activating DNA Nanomachine via Computation across Cancer Cell Membrane for Precise Therapy of Solid Tumors”为题于9月2日在Journal of the American Chemical Society(DOI: 10.1021/jacs.1c06361)在线发表。博士生张玥和陈伟伟副研究员为该工作的共同第一作者,鞠熀先教授和刘颖教授为共同通讯作者。
该研究团队近年来围绕“癌症高效精准诊疗中的上转换纳米探针的研制及其性能研究”取得一系性创新成果。设计了发光增强的“能量集中域”结构上转换纳米材料(Angew. Chem. Int. Ed. 2019 58 12117-12122),开发了中继式能量传递模式提高了能量转移效率(CCS Chem. 2021 3 1510-1521),实现了上转换发光驱动的DNA偶氮苯纳米泵用于化疗药物的可控释放(Angew. Chem. Int. Ed. 2019 58 18207-18211)和近红外光响应microRNA放大器的早期癌症精准光动力治疗(Angew. Chem. Int. Ed. 2020 59 21454-21459),提出近红外光控撕裂上转换纳米胶囊的siRNA递运和基因治疗策略(Biomaterials 2018 163 55-66),通过近红外光瞬间点燃上转换纳米炸弹,实现了快速药物释放和癌症高效治疗(J. Control. Release 2021 336 469-479)。
这些系列工作得到国家自然科学基金重大项目课题(21890741)、重点项目(21635005)、面上项目(21974064)、优秀青年基金(22022405)、青年基金(22004062),江苏省自然科学基金杰出青年基金(BK20200010)与双创人才基金,和生命分析化学国家重点实验室的支持。
来源:南京大学




